Chào bạn! Có bao giờ bạn tự hỏi, tại sao nước lại là nước, không khí lại là không khí, hay chiếc cốc nhựa bạn đang dùng lại có hình dạng và tính chất như vậy chưa? Đằng sau sự đa dạng và ổn định của thế giới vật chất quanh ta ẩn chứa những “mắt xích” vô cùng quan trọng. Một trong những loại mắt xích cơ bản và phổ biến nhất đó chính là liên kết hóa học. Và hôm nay, chúng ta sẽ cùng “giải mã” một loại liên kết đặc biệt: Liên Kết Cộng Hóa Trị Là Gì? Ngay trong 50 từ đầu tiên này, bạn đã biết rằng liên kết cộng hóa trị đóng vai trò then chốt trong việc hình thành hầu hết các chất mà chúng ta thấy hàng ngày, từ nước uống, không khí hít thở cho đến cơ thể sống.
Trong vũ trụ hóa học bao la, các nguyên tử không tồn tại riêng lẻ một cách tùy tiện. Chúng có xu hướng kết hợp với nhau để đạt được trạng thái bền vững hơn, thường là có lớp vỏ electron ngoài cùng đầy đủ, giống như các khí hiếm. Sự kết hợp này diễn ra thông qua các loại liên kết hóa học khác nhau. Liên kết cộng hóa trị là một trong những “keo dán” mạnh mẽ và linh hoạt nhất, chịu trách nhiệm tạo nên vô số phân tử, từ những phân tử đơn giản như oxy (O2), nitơ (N2) cho đến những phân tử phức tạp khổng lồ cấu tạo nên sự sống như protein hay DNA.
Hiểu về liên kết cộng hóa trị không chỉ là kiến thức cơ bản trong hóa học mà còn giúp chúng ta lý giải rất nhiều hiện tượng trong đời sống và đặc biệt quan trọng trong lĩnh vực môi trường. Tại sao một số chất lại tan trong nước, trong khi chất khác lại không? Tại sao nhựa lại bền bỉ đến vậy? Tại sao một số hóa chất lại độc hại với môi trường và sức khỏe con người? Câu trả lời thường nằm sâu bên trong cấu trúc phân tử, được tạo nên bởi chính những liên kết cộng hóa trị này. Với vai trò là Chuyên gia Nội dung của CÔNG TY TNHH MÔI TRƯỜNG HSE, chúng tôi tin rằng việc trang bị kiến thức nền tảng về các khái niệm hóa học, dù cơ bản nhất, là cực kỳ cần thiết để bạn có cái nhìn toàn diện và sâu sắc hơn về các vấn đề môi trường đang diễn ra quanh ta. Hãy cùng nhau khám phá thế giới kỳ diệu của liên kết cộng hóa trị nhé!
Liên Kết Cộng Hóa Trị Là Gì? Định Nghĩa Đơn Giản Nhất
Liên kết cộng hóa trị là gì? Đó là một loại liên kết hóa học được hình thành do sự góp chung và chia sẻ electron giữa hai hoặc nhiều nguyên tử.
Nói một cách dễ hiểu, thay vì một nguyên tử “cho” hẳn electron và một nguyên tử “nhận” hẳn electron như trong liên kết ion, thì trong liên kết cộng hóa trị, các nguyên tử “rủ nhau” mang electron độc thân của mình ra “góp vốn” và tạo thành cặp electron dùng chung. Cặp electron dùng chung này bị hút bởi hạt nhân của cả hai nguyên tử tham gia liên kết, tạo ra lực giữ hai nguyên tử lại gần nhau, hình thành nên phân tử.
Bạn cứ hình dung thế này: mỗi nguyên tử giống như một người đang muốn có đủ đồ đạc để “căn nhà” (lớp vỏ electron ngoài cùng) của mình thật đầy đủ và vững chãi. Trong liên kết ion, một người “giàu” (có dư electron ở lớp ngoài) sẽ cho người “nghèo” (bị thiếu electron) mượn hẳn đồ. Còn trong liên kết cộng hóa trị, hai người đều đang thiếu đồ một chút, nên họ quyết định “góp” đồ của mình lại và để chung ở một nơi, cả hai cùng sử dụng chung số đồ đó để “căn nhà” của cả hai đều trở nên đầy đủ hơn. Sự “góp chung và dùng chung” này chính là bản chất của liên kết cộng hóa trị.
Để hiểu rõ hơn về liên kết cộng hóa trị là, chúng ta cần đi sâu vào cách nó được hình thành và những yếu tố nào quyết định sự hình thành đó.
Liên Kết Cộng Hóa Trị Được Hình Thành Do Đâu?
Liên kết cộng hóa trị được hình thành do sự góp chung electron giữa các nguyên tử phi kim (thường là với nhau) hoặc giữa nguyên tử phi kim với nguyên tử hydro.
Sự hình thành liên kết cộng hóa trị dựa trên nguyên tắc cơ bản là các nguyên tử có xu hướng đạt được cấu hình electron bền vững của khí hiếm gần nhất (thường là 8 electron ở lớp vỏ ngoài cùng, trừ heli là 2 electron – quy tắc octet hay quy tắc bát tử). Khi hai nguyên tử phi kim lại gần nhau, nếu mỗi nguyên tử đều thiếu một vài electron để đạt được cấu hình bền vững, thay vì nhường hoặc nhận hoàn toàn, chúng sẽ lựa chọn cách góp các electron độc thân của mình để tạo thành những cặp electron dùng chung. Mỗi cặp electron dùng chung này tạo nên một liên kết cộng hóa trị đơn.
Ví dụ kinh điển nhất chính là phân tử hydro (H2). Mỗi nguyên tử hydro có 1 electron ở lớp vỏ ngoài cùng. Để đạt được cấu hình bền vững giống heli (2 electron), hai nguyên tử hydro sẽ lại gần nhau, mỗi nguyên tử góp 1 electron để tạo thành 1 cặp electron dùng chung. Cặp electron này nằm giữa hai hạt nhân hydro và bị cả hai hút, giữ hai nguyên tử hydro lại với nhau.
Một ví dụ khác là phân tử clo (Cl2). Nguyên tử clo có 7 electron ở lớp vỏ ngoài cùng (thiếu 1 electron để đạt 8). Hai nguyên tử clo sẽ góp chung 1 cặp electron, mỗi nguyên tử đóng góp 1 electron. Khi đó, mỗi nguyên tử clo đều có “chung” 1 cặp electron với nguyên tử kia, khiến lớp vỏ ngoài cùng của mỗi nguyên tử clo đều có 8 electron, đạt cấu hình bền vững.
Bạn thấy không, quá trình này thực sự rất “dân chủ” và “hợp tác”. Mỗi bên đều đóng góp một phần và cùng nhau hưởng lợi từ sự đóng góp đó. Để tìm hiểu chi tiết hơn về quá trình này, đặc biệt là liên kết cộng hóa trị được hình thành do những yếu tố nào chi phối, bạn có thể tham khảo sâu hơn các tài liệu chuyên ngành.
 Minh họa sự hình thành liên kết cộng hóa trị đơn giản giữa hai nguyên tử hydro bằng cách góp chung electron
Minh họa sự hình thành liên kết cộng hóa trị đơn giản giữa hai nguyên tử hydro bằng cách góp chung electron
Tại Sao Nguyên Tử Lại Tạo Liên Kết Cộng Hóa Trị? (Quy Tắc Octet)
Nguyên tử tạo liên kết cộng hóa trị chủ yếu là để đạt được cấu hình electron bền vững giống các khí hiếm, thường là có 8 electron ở lớp vỏ ngoài cùng (quy tắc octet).
Quy tắc octet (hay quy tắc bát tử) là một nguyên tắc quan trọng giúp dự đoán cách các nguyên tử sẽ liên kết với nhau. Theo quy tắc này, các nguyên tử có xu hướng tương tác (bằng cách nhận, nhường hoặc góp chung electron) để lớp vỏ electron ngoài cùng của chúng có đủ 8 electron. Đây là cấu hình cực kỳ bền vững, giải thích tại sao các khí hiếm (như Neon, Argon) lại rất trơ về mặt hóa học, chúng không dễ dàng tham gia phản ứng.
Đối với các nguyên tử phi kim, chúng thường có 4, 5, 6, hoặc 7 electron ở lớp vỏ ngoài cùng. Việc nhường đi một lượng lớn electron hoặc nhận thêm một lượng lớn electron để đạt cấu hình khí hiếm gần nhất thường đòi hỏi nhiều năng lượng và không phải lúc nào cũng thuận lợi. Thay vào đó, việc góp chung electron với các nguyên tử phi kim khác trở thành một cách hiệu quả để cả hai cùng “hoàn thành” lớp vỏ ngoài cùng của mình với 8 electron.
Ví dụ:
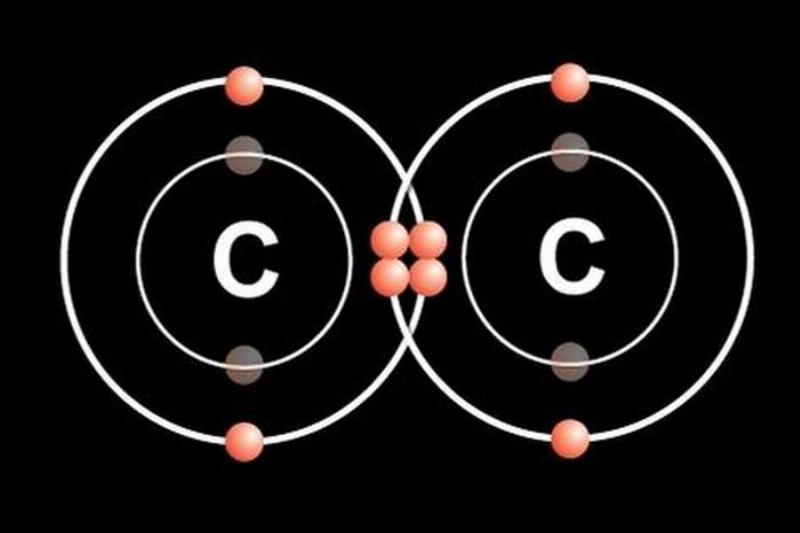
- Nguyên tử Carbon (C) có 4 electron lớp ngoài cùng. Để đạt 8, nó cần thêm 4 electron. Carbon thường tạo 4 liên kết cộng hóa trị (ví dụ trong CH4 – methane).
- Nguyên tử Oxy (O) có 6 electron lớp ngoài cùng. Cần thêm 2 electron. Oxy thường tạo 2 liên kết cộng hóa trị (ví dụ trong H2O – nước) hoặc 1 liên kết đôi (ví dụ trong O2 – oxy).
- Nguyên tử Nitơ (N) có 5 electron lớp ngoài cùng. Cần thêm 3 electron. Nitơ thường tạo 3 liên kết cộng hóa trị (ví dụ trong NH3 – amoniac) hoặc 1 liên kết ba (ví dụ trong N2 – nitơ).
Quy tắc octet là một quy tắc mang tính định hướng và có một số ngoại lệ, đặc biệt là với các nguyên tố chu kỳ 3 trở lên (như P, S, Cl) có thể mở rộng lớp vỏ hóa trị của mình, nhưng nhìn chung, nó là một công cụ rất hữu ích để hiểu về liên kết cộng hóa trị.
Các Loại Liên Kết Cộng Hóa Trị: Đơn, Đôi, Ba
Liên kết cộng hóa trị không chỉ có một kiểu duy nhất. Tùy thuộc vào số cặp electron mà các nguyên tử góp chung, chúng ta có thể phân loại thành ba loại chính: liên kết đơn, liên kết đôi và liên kết ba.
Liên Kết Cộng Hóa Trị Đơn
Liên kết cộng hóa trị đơn được hình thành khi hai nguyên tử góp chung và chia sẻ một cặp electron.
Đây là loại liên kết cộng hóa trị cơ bản nhất, được tạo thành từ sự góp chung của một electron từ mỗi nguyên tử (hoặc một nguyên tử góp cả cặp electron mà nguyên tử kia không góp gì, gọi là liên kết cho-nhận, nhưng bản chất vẫn là dùng chung). Liên kết đơn thường được biểu diễn bằng một gạch ngang (-) nối giữa ký hiệu hóa học của hai nguyên tử.
Ví dụ:
- Phân tử Hydro (H-H): Hai nguyên tử H góp chung 1 cặp electron.
- Phân tử Clo (Cl-Cl): Hai nguyên tử Cl góp chung 1 cặp electron.
- Phân tử Nước (H-O-H): Mỗi nguyên tử H góp chung 1 cặp electron với nguyên tử O, và nguyên tử O góp chung 1 cặp electron với mỗi nguyên tử H.
- Phân tử Methane (CH4): Nguyên tử C tạo 4 liên kết đơn với 4 nguyên tử H.
Liên kết đơn là loại liên kết dài nhất và yếu nhất trong ba loại liên kết cộng hóa trị, vì lực hút giữa hạt nhân và chỉ một cặp electron chung là nhỏ nhất.
Liên Kết Cộng Hóa Trị Đôi
Liên kết cộng hóa trị đôi được hình thành khi hai nguyên tử góp chung và chia sẻ hai cặp electron.
Điều này xảy ra khi mỗi nguyên tử cần thêm 2 electron để đạt cấu hình bền vững và chúng quyết định góp chung 2 electron mỗi bên, tạo thành 2 cặp electron dùng chung. Liên kết đôi thường được biểu diễn bằng hai gạch ngang (=) nối giữa hai nguyên tử.
Ví dụ:
- Phân tử Oxy (O=O): Mỗi nguyên tử O có 6 electron lớp ngoài, cần thêm 2. Hai nguyên tử O góp chung 2 cặp electron.
- Phân tử Carbon dioxide (O=C=O): Nguyên tử C cần 4 electron, nguyên tử O cần 2. Nguyên tử C tạo 2 liên kết đôi với hai nguyên tử O.
- Phân tử Ethylene (C2H4): Hai nguyên tử C tạo 1 liên kết đôi với nhau và mỗi C tạo 2 liên kết đơn với 2 nguyên tử H.
Liên kết đôi ngắn hơn và mạnh hơn liên kết đơn vì lực hút giữa hạt nhân và hai cặp electron chung lớn hơn.
Liên Kết Cộng Hóa Trị Ba
Liên kết cộng hóa trị ba được hình thành khi hai nguyên tử góp chung và chia sẻ ba cặp electron.
Đây là loại liên kết mạnh nhất trong ba loại, xảy ra khi mỗi nguyên tử cần thêm 3 electron để đạt cấu hình bền vững và chúng góp chung 3 electron mỗi bên, tạo thành 3 cặp electron dùng chung. Liên kết ba thường được biểu diễn bằng ba gạch ngang (≡) nối giữa hai nguyên tử.
Ví dụ:
- Phân tử Nitơ (N≡N): Mỗi nguyên tử N có 5 electron lớp ngoài, cần thêm 3. Hai nguyên tử N góp chung 3 cặp electron.
- Phân tử Acetylene (H-C≡C-H): Hai nguyên tử C tạo 1 liên kết ba với nhau và mỗi C tạo 1 liên kết đơn với 1 nguyên tử H.
Liên kết ba là loại liên kết ngắn nhất và mạnh nhất trong ba loại liên kết cộng hóa trị, đòi hỏi năng lượng phá vỡ rất lớn. Điều này giải thích tại sao khí nitơ (N2) trong không khí lại rất trơ và khó tham gia phản ứng hóa học ở điều kiện thường – nhờ có liên kết ba bền vững này.
Hiểu về các loại liên kết này giúp chúng ta dự đoán cấu trúc và một phần tính chất của các phân tử. Chẳng hạn, phân tử càng có nhiều liên kết đôi hoặc ba thì cấu trúc càng chặt chẽ hơn, và năng lượng cần để phá vỡ phân tử đó cũng lớn hơn.
 Minh họa sự khác biệt giữa liên kết đơn, đôi và ba trong hóa học bằng cách hiển thị số lượng cặp electron dùng chung
Minh họa sự khác biệt giữa liên kết đơn, đôi và ba trong hóa học bằng cách hiển thị số lượng cặp electron dùng chung
Liên Kết Cộng Hóa Trị Có Phân Cực Hay Không Phân Cực?
Không phải lúc nào sự chia sẻ electron trong liên kết cộng hóa trị cũng “công bằng” tuyệt đối. Tùy thuộc vào bản chất của các nguyên tử tham gia liên kết, sự chia sẻ electron có thể đồng đều hoặc không đồng đều, dẫn đến sự phân cực của liên kết.
Liên Kết Cộng Hóa Trị Không Phân Cực
Liên kết cộng hóa trị không phân cực xảy ra khi hai nguyên tử cùng loại (hoặc hai nguyên tử có độ âm điện tương đương) góp chung electron, khiến cặp electron dùng chung được phân bố đều giữa hai hạt nhân.
Độ âm điện là khả năng hút electron của một nguyên tử khi tham gia liên kết hóa học. Khi hai nguyên tử cùng loại liên kết với nhau (ví dụ: H2, O2, N2, Cl2), độ âm điện của chúng bằng nhau, nên cặp electron dùng chung không bị lệch về phía nguyên tử nào cả. Chúng nằm “ngay giữa” hai hạt nhân. Kết quả là liên kết không có sự phân cực về điện tích.
Ngay cả khi liên kết giữa hai nguyên tử khác loại, nếu hiệu độ âm điện giữa chúng rất nhỏ hoặc bằng không (tuy hiếm), liên kết đó cũng được coi là không phân cực hoặc gần như không phân cực.
Liên Kết Cộng Hóa Trị Phân Cực
Liên kết cộng hóa trị phân cực xảy ra khi hai nguyên tử khác loại có độ âm điện khác nhau đáng kể góp chung electron, khiến cặp electron dùng chung bị lệch về phía nguyên tử có độ âm điện lớn hơn.
Khi độ âm điện khác nhau, nguyên tử có độ âm điện lớn hơn sẽ “hút” cặp electron dùng chung mạnh hơn. Điều này làm cho khu vực xung quanh nguyên tử có độ âm điện lớn hơn tích điện âm một phần (ký hiệu δ-), còn khu vực xung quanh nguyên tử kia tích điện dương một phần (ký hiệu δ+). Mặc dù electron vẫn là dùng chung, nhưng sự phân bố không đồng đều này tạo ra hai “cực” điện tích trên liên kết, giống như một nam châm nhỏ.
Ví dụ điển hình nhất là liên kết O-H trong phân tử nước (H2O). Oxy có độ âm điện lớn hơn Hydro. Do đó, các cặp electron dùng chung trong liên kết O-H bị lệch về phía nguyên tử Oxy. Nguyên tử Oxy tích điện âm một phần (δ-), còn mỗi nguyên tử Hydro tích điện dương một phần (δ+).
Sự phân cực của liên kết cộng hóa trị là yếu tố cực kỳ quan trọng, ảnh hưởng trực tiếp đến tính chất của phân tử và chất. Ví dụ, phân tử nước phân cực mạnh, tạo ra khả năng hòa tan nhiều chất khác (dung môi phổ biến nhất), khả năng tạo liên kết hydro, và ảnh hưởng đến nhiệt độ sôi, nhiệt độ nóng chảy của nước.
Phân Cực Phân Tử và Phân Cực Liên Kết
Cần phân biệt rõ ràng giữa phân cực liên kết và phân cực phân tử.
- Phân cực liên kết: Chỉ xảy ra khi liên kết giữa hai nguyên tử khác loại có hiệu độ âm điện đáng kể.
- Phân cực phân tử: Phân tử được coi là phân cực nếu tổng hợp các momen lưỡng cực của tất cả các liên kết trong phân tử tạo ra một momen lưỡng cực tổng khác không. Điều này phụ thuộc vào cả độ phân cực của từng liên kết và cấu trúc hình học của phân tử.
Ví dụ: Phân tử CO2 (O=C=O). Mỗi liên kết C=O đều là liên kết phân cực (O có độ âm điện lớn hơn C). Tuy nhiên, phân tử CO2 có cấu trúc thẳng, hai momen lưỡng cực của hai liên kết C=O hướng ngược chiều nhau và có độ lớn bằng nhau, nên chúng triệt tiêu lẫn nhau. Kết quả là phân tử CO2 là phân tử không phân cực.
Ngược lại, phân tử nước (H2O) có cấu trúc góc. Hai liên kết O-H đều phân cực và hướng về phía O. Momen lưỡng cực của hai liên kết này không triệt tiêu mà tổng hợp lại, tạo ra một momen lưỡng cực tổng khác không. Do đó, phân tử nước là phân tử phân cực.
Việc một phân tử là phân cực hay không phân cực quyết định rất nhiều đến tính chất vật lý và hóa học của chất đó, ví dụ như khả năng hòa tan (chất phân cực thường tan tốt trong dung môi phân cực như nước, chất không phân cực tan tốt trong dung môi không phân cực), nhiệt độ sôi, và tương tác giữa các phân tử với nhau.
 So sánh cấu trúc và sự phân bố điện tích trong phân tử nước (phân cực) và carbon dioxide (không phân cực) để minh họa liên kết cộng hóa trị phân cực và không phân cực cũng như phân cực phân tử
So sánh cấu trúc và sự phân bố điện tích trong phân tử nước (phân cực) và carbon dioxide (không phân cực) để minh họa liên kết cộng hóa trị phân cực và không phân cực cũng như phân cực phân tử
Tính Chất Của Các Chất Có Liên Kết Cộng Hóa Trị
Các chất được tạo thành từ các phân tử liên kết với nhau bằng liên kết cộng hóa trị (gọi là các hợp chất cộng hóa trị) thường có những tính chất đặc trưng khác biệt so với các hợp chất ion hay kim loại.
Trạng Thái Tập Hợp
Ở điều kiện thường, các hợp chất cộng hóa trị thường tồn tại ở cả ba trạng thái:
- Khí: Các chất có phân tử khối nhỏ, lực liên kết giữa các phân tử yếu, ví dụ: H2, O2, N2, CO2, CH4.
- Lỏng: Các chất có phân tử khối lớn hơn hoặc có khả năng tạo liên kết liên phân tử (như liên kết hydro), ví dụ: H2O, C2H5OH (ethanol), C6H14 (hexane).
- Rắn: Các chất có phân tử khối lớn, cấu trúc mạng tinh thể phân tử hoặc mạng tinh thể nguyên tử.
- Mạng tinh thể phân tử: Các phân tử liên kết với nhau bằng lực hút yếu giữa các phân tử (lực Van der Waals, liên kết hydro). Ví dụ: I2, S8, đường (sucrose), nước đá. Thường có nhiệt độ nóng chảy, nhiệt độ sôi thấp.
- Mạng tinh thể nguyên tử (mạng lưới cộng hóa trị): Các nguyên tử liên kết trực tiếp với nhau bằng liên kết cộng hóa trị bền vững tạo thành một cấu trúc mạng lưới khổng lồ. Ví dụ: Kim cương (Carbon), Silic (Si), Silic dioxide (SiO2 – thạch anh). Thường có nhiệt độ nóng chảy, nhiệt độ sôi rất cao.
Nhiệt Độ Nóng Chảy và Nhiệt Độ Sôi
Nói chung, các hợp chất cộng hóa trị (đặc biệt là cấu trúc phân tử) có nhiệt độ nóng chảy và nhiệt độ sôi thấp hơn nhiều so với hợp chất ion. Điều này là do khi nóng chảy hoặc sôi, chúng ta chỉ cần cung cấp đủ năng lượng để phá vỡ lực liên kết yếu giữa các phân tử, chứ không phải phá vỡ liên kết cộng hóa trị mạnh bên trong phân tử.
Tuy nhiên, các chất có mạng tinh thể nguyên tử (như kim cương) lại có nhiệt độ nóng chảy và sôi cực cao vì việc phá vỡ cấu trúc này đòi hỏi phải phá vỡ các liên kết cộng hóa trị rất bền vững.
Độ Tan
Độ tan của hợp chất cộng hóa trị trong dung môi phụ thuộc vào độ phân cực của cả chất tan và dung môi, tuân theo nguyên tắc “Like dissolves like” (chất phân cực tan trong dung môi phân cực, chất không phân cực tan trong dung môi không phân cực).
- Các hợp chất cộng hóa trị phân cực (như đường, ethanol) thường tan tốt trong dung môi phân cực (như nước).
- Các hợp chất cộng hóa trị không phân cực (như dầu, mỡ, hexane) thường tan tốt trong dung môi không phân cực (như xăng, benzen).
- Các hợp chất không phân cực thường không tan hoặc tan rất ít trong dung môi phân cực như nước.
Điều này giải thích tại sao dầu ăn không tan trong nước, trong khi muối ăn (hợp chất ion) lại tan rất tốt trong nước. Đối với những ai quan tâm đến chất làm mềm nước cứng tạm thời, việc hiểu về tính tan của các hợp chất trong nước là cực kỳ cơ bản.
Khả Năng Dẫn Điện
Hầu hết các hợp chất cộng hóa trị (ở cả trạng thái rắn, lỏng hay dung dịch) đều không dẫn điện. Lý do là chúng không chứa các hạt mang điện tự do (electron tự do hoặc ion). Các electron hóa trị đã bị “khóa” trong các liên kết cộng hóa trị hoặc nằm trong các cặp electron không liên kết, không thể di chuyển tự do để tạo ra dòng điện.
Ngoại lệ đáng chú ý là than chì (graphite) – một dạng thù hình của carbon. Trong than chì, mỗi nguyên tử carbon liên kết cộng hóa trị với ba nguyên tử carbon khác trong một lớp phẳng, tạo thành cấu trúc lớp. Mỗi nguyên tử carbon còn dư một electron chưa liên kết và những electron này có thể di chuyển tự do giữa các lớp, làm cho than chì có khả năng dẫn điện (dù không tốt bằng kim loại).
Ví Dụ Về Liên Kết Cộng Hóa Trị Trong Đời Sống Hàng Ngày
Liên kết cộng hóa trị hiện diện khắp mọi nơi quanh chúng ta, cấu tạo nên vô số vật chất quen thuộc.
- Nước (H2O): Có lẽ là ví dụ gần gũi nhất. Hai liên kết O-H trong phân tử nước là liên kết cộng hóa trị phân cực. Chính sự phân cực này tạo nên rất nhiều tính chất đặc biệt của nước, biến nó trở thành dung môi của sự sống và đóng vai trò trung tâm trong các quá trình môi trường.
- Không Khí: Thành phần chính của không khí là khí Nitơ (N2) và khí Oxy (O2). Cả hai đều là các phân tử được hình thành từ liên kết cộng hóa trị (N≡N và O=O). Liên kết ba trong N2 rất bền, khiến N2 trơ và không tham gia phản ứng dễ dàng. Liên kết đôi trong O2 kém bền hơn, cho phép O2 tham gia vào quá trình cháy, hô hấp. Khí Carbon dioxide (CO2) cũng có liên kết cộng hóa trị (O=C=O).
- Đường và Muối: Đường ăn (sucrose) là một hợp chất hữu cơ phức tạp với rất nhiều liên kết cộng hóa trị bên trong phân tử. Muối ăn (NaCl) là hợp chất ion. Sự khác biệt về liên kết giải thích tại sao đường nóng chảy ở nhiệt độ tương đối thấp và có thể cháy, trong khi muối nóng chảy ở nhiệt độ rất cao.
- Nhựa: Các loại nhựa phổ biến như polyethylene, polypropylene, PVC đều là các polymer khổng lồ. Cấu trúc cơ bản của chúng là các mạch carbon dài được liên kết với nhau và với các nguyên tử khác (như H, Cl) bằng liên kết cộng hóa trị. Chính nhờ sự bền vững của các liên kết cộng hóa trị này mà nhựa rất bền và khó phân hủy trong môi trường, gây ra vấn đề ô nhiễm nghiêm trọng. Để hiểu rõ hơn về cách các phân tử lớn như polymer được tạo thành, bạn có thể tìm hiểu về phản ứng trùng hợp là gì.
- Quần áo, gỗ, giấy: Cotton, len, lụa (trong quần áo) đều là các vật liệu tự nhiên cấu tạo chủ yếu từ các phân tử hữu cơ khổng lồ (như cellulose, protein) được giữ với nhau bởi liên kết cộng hóa trị. Gỗ và giấy cũng chứa nhiều cellulose và lignin – những hợp chất hữu cơ có cấu trúc cộng hóa trị phức tạp.
- Cơ thể sống: Từ các phân tử đơn giản như nước, oxy cho đến các đại phân tử phức tạp như carbohydrate, lipid, protein, axit nucleic (DNA, RNA) – tất cả đều được tạo thành từ các nguyên tử liên kết với nhau bằng liên kết cộng hóa trị. Chúng là nền tảng hóa học của sự sống.
Tầm Quan Trọng Của Liên Kết Cộng Hóa Trị Trong Hóa Học và Môi Trường
Liên kết cộng hóa trị không chỉ là một khái niệm hàn lâm trong sách giáo khoa, mà nó còn là nền tảng để hiểu về thế giới hóa học và đặc biệt là các quá trình môi trường.
Nền Tảng Hóa Học
Hầu hết các hợp chất hữu cơ, lĩnh vực nghiên cứu chính của hóa học hữu cơ, đều được tạo thành từ các nguyên tử carbon liên kết với nhau và với các nguyên tử khác (H, O, N, S, halogen) bằng liên kết cộng hóa trị. Sự đa dạng và khả năng tạo liên kết mạnh mẽ của carbon (có thể tạo 4 liên kết đơn, đôi hoặc ba) cho phép hình thành hàng triệu hợp chất hữu cơ khác nhau với cấu trúc và tính chất vô cùng phong phú. Đây là lý do tại sao hóa học hữu cơ lại là một nhánh rộng lớn và quan trọng đến vậy, nó nghiên cứu về hầu hết các chất tạo nên sinh vật sống và các vật liệu dựa trên carbon.
Liên kết cộng hóa trị cũng đóng vai trò quan trọng trong hóa học vô cơ, đặc biệt là trong các hợp chất của phi kim với nhau (như SO2, SO3, NxOy) hoặc các hợp chất phức tạp hơn.
Hiểu cách các nguyên tử liên kết với nhau bằng liên kết cộng hóa trị giúp chúng ta dự đoán tính chất của các chất, giải thích tại sao chúng phản ứng theo cách này hay cách khác, và thậm chí là thiết kế các vật liệu mới với tính chất mong muốn.
Liên Kết Cộng Hóa Trị và Hóa Học Môi Trường
Trong bối cảnh môi trường, việc hiểu về liên kết cộng hóa trị là cực kỳ quan trọng để giải quyết các vấn đề như ô nhiễm, xử lý chất thải, và phát triển các công nghệ xanh.
- Chất ô nhiễm: Nhiều chất ô nhiễm trong không khí (SO2, NO2, CO), nước (thuốc trừ sâu, hóa chất hữu cơ khó phân hủy – POPs), và đất đều là các hợp chất cộng hóa trị. Tính chất của chúng (độ bền, độ tan, khả năng phản ứng) phụ thuộc rất nhiều vào loại và sự sắp xếp của các liên kết cộng hóa trị bên trong phân tử. Ví dụ, độ bền vững của liên kết C-Cl trong các hợp chất clo hữu cơ (như PCB, DDT) khiến chúng khó bị phân hủy sinh học và tích tụ trong môi trường, gây độc hại.
- Xử lý môi trường: Các công nghệ xử lý nước thải, khí thải thường dựa trên các phản ứng hóa học. Hiểu biết về liên kết cộng hóa trị giúp lựa chọn hóa chất và điều kiện phản ứng phù hợp để chuyển hóa các chất ô nhiễm thành dạng ít độc hơn hoặc dễ loại bỏ hơn. Ví dụ, quá trình oxy hóa các chất hữu cơ trong nước thải thường liên quan đến việc phá vỡ các liên kết C-C, C-H, C-O… bằng các tác nhân oxy hóa mạnh.
- Vật liệu môi trường: Việc phát triển các vật liệu thân thiện với môi trường, như vật liệu phân hủy sinh học, vật liệu hấp phụ chất ô nhiễm, cũng đòi hỏi hiểu biết sâu sắc về cấu trúc phân tử và liên kết cộng hóa trị. Ví dụ, nhựa phân hủy sinh học thường có các liên kết cộng hóa trị kém bền hơn, dễ dàng bị phá vỡ bởi vi sinh vật hoặc điều kiện môi trường.
- Hiện tượng môi trường: Ngay cả những hiện tượng tự nhiên như mưa axit (do SO2, NO2 phản ứng với nước tạo H2SO4, HNO3 – đều chứa liên kết cộng hóa trị) hay hiệu ứng nhà kính (liên quan đến CO2, CH4 – đều là hợp chất cộng hóa trị) cũng được giải thích thông qua tính chất hóa học của các phân tử này, vốn phụ thuộc vào liên kết cộng hóa trị.
Hiểu biết về bảo vệ môi trường nước cũng không thể thiếu nền tảng hóa học, trong đó có kiến thức về liên kết cộng hóa trị, bởi nước là dung môi của rất nhiều chất, và các chất ô nhiễm trong nước đa phần là các hợp chất cộng hóa trị hoặc ion.
So Sánh Liên Kết Cộng Hóa Trị Với Các Loại Liên Kết Khác
Để làm nổi bật bản chất của liên kết cộng hóa trị, chúng ta nên so sánh nó với hai loại liên kết hóa học phổ biến khác: liên kết ion và liên kết kim loại.
| Đặc Điểm | Liên Kết Cộng Hóa Trị | Liên Kết Ion | Liên Kết Kim Loại |
|---|---|---|---|
| Cách Hình Thành | Góp chung và chia sẻ electron giữa các nguyên tử. | Nhường electron từ kim loại sang phi kim, tạo ion. | Các ion kim loại dương được giữ bởi “biển” electron tự do. |
| Các Nguyên Tử Tham Gia | Thường là phi kim với phi kim, hoặc phi kim với Hydro. | Kim loại điển hình với phi kim điển hình. | Kim loại với kim loại. |
| Độ Âm Điện | Hiệu độ âm điện nhỏ hoặc trung bình (0 đến ~1.7). | Hiệu độ âm điện lớn (> ~1.7). | Độ âm điện thấp, gần bằng nhau giữa các nguyên tử kim loại. |
| Đơn Vị Cấu Trúc | Phân tử (thường), hoặc mạng tinh thể nguyên tử. | Mạng tinh thể ion (các ion dương và âm sắp xếp đều đặn). | Mạng tinh thể kim loại (các ion dương trong “biển” electron). |
| Nhiệt Độ Nóng Chảy/Sôi | Thấp đến rất cao (phụ thuộc cấu trúc). | Cao. | Trung bình đến rất cao. |
| Độ Cứng | Mềm (cấu trúc phân tử) đến rất cứng (mạng nguyên tử). | Cứng và giòn. | Trung bình đến cứng, dẻo dai. |
| Khả Năng Dẫn Điện | Hầu hết không dẫn điện (trừ than chì, dung dịch axit/bazơ mạnh…). | Dẫn điện khi nóng chảy hoặc tan trong nước (do có ion tự do). | Dẫn điện tốt ở cả trạng thái rắn và lỏng (do có electron tự do). |
| Ví Dụ | H2O, CO2, O2, CH4, C6H12O6 (đường), kim cương. | NaCl, MgO, CaCl2. | Fe, Cu, Al, Au, Ag. |
Sự khác biệt về cách hình thành liên kết dẫn đến sự khác biệt rõ rệt về tính chất vật lý và hóa học của các chất. Hiểu được sự khác biệt này giúp chúng ta phân loại và dự đoán tính chất của các hợp chất hóa học.
Giải Đáp Những Câu Hỏi Thường Gặp Về Liên Kết Cộng Hóa Trị
Khi tìm hiểu về liên kết cộng hóa trị, có thể bạn sẽ có những thắc mắc tương tự. Dưới đây là tổng hợp một số câu hỏi thường gặp và câu trả lời ngắn gọn, dễ hiểu.
Liên Kết Cộng Hóa Trị Có Phải Là Liên Kết Mạnh Nhất Không?
Liên kết cộng hóa trị đơn không phải là liên kết mạnh nhất, nhưng liên kết cộng hóa trị đôi và ba thì rất mạnh, thậm chí mạnh hơn nhiều liên kết ion điển hình. Độ bền của liên kết phụ thuộc vào số cặp electron dùng chung và bản chất của các nguyên tử tham gia.
Liên Kết Cộng Hóa Trị Có Thể Tồn Tại Giữa Những Nguyên Tử Nào?
Liên kết cộng hóa trị chủ yếu tồn tại giữa các nguyên tử phi kim với nhau và giữa nguyên tử phi kim với nguyên tử hydro. Đôi khi cũng xuất hiện trong các hợp chất chứa kim loại nhưng liên kết giữa kim loại và phi kim lại có bản chất cộng hóa trị đáng kể (ví dụ: BeCl2, AlCl3).
Làm Thế Nào Để Dự Đoán Số Liên Kết Cộng Hóa Trị Mà Một Nguyên Tử Sẽ Tạo Ra?
Có thể dự đoán dựa vào số electron mà nguyên tử cần để đạt cấu hình octet. Ví dụ, Carbon cần 4 electron, nên thường tạo 4 liên kết cộng hóa trị. Oxy cần 2 electron, thường tạo 2 liên kết. Nitơ cần 3 electron, thường tạo 3 liên kết.
Cặp Electron Không Liên Kết Là Gì?
Cặp electron không liên kết (hay cặp electron tự do) là cặp electron ở lớp vỏ ngoài cùng của nguyên tử nhưng không tham gia vào việc tạo liên kết cộng hóa trị với nguyên tử khác. Chúng vẫn thuộc về nguyên tử đó và ảnh hưởng đến hình dạng của phân tử (ví dụ, hai cặp electron không liên kết trên nguyên tử Oxy trong nước làm cho phân tử nước có cấu trúc góc).
Tại Sao Nước Lại Là Dung Môi Tốt Cho Nhiều Chất?
Nước là dung môi tốt cho nhiều chất (đặc biệt là chất phân cực và hợp chất ion) là do phân tử nước là phân tử phân cực mạnh. Sự phân cực này cho phép nước tương tác mạnh mẽ với các phân tử phân cực khác và các ion, giúp chúng tan trong nước.
Liên Kết Cộng Hóa Trị Có Vai Trò Gì Trong Sinh Học?
Liên kết cộng hóa trị là “xương sống” của hầu hết các phân tử sinh học như protein, carbohydrate, lipid, và axit nucleic. Chúng tạo nên cấu trúc bền vững của các đại phân tử này, cho phép chúng thực hiện các chức năng phức tạp trong tế bào và cơ thể sống.
Làm Thế Nào Việc Hiểu Liên Kết Cộng Hóa Trị Giúp Ích Cho Việc Bảo Vệ Môi Trường?
Hiểu liên kết cộng hóa trị giúp chúng ta hiểu tính chất và hành vi của các chất hóa học trong môi trường, bao gồm cả chất ô nhiễm. Điều này là cơ sở để phát triển phương pháp phát hiện, phân tích, xử lý các chất ô nhiễm và thiết kế vật liệu thân thiện với môi trường.
Một Góc Nhìn Chuyên Gia Về Liên Kết Cộng Hóa Trị Trong Môi Trường
Để thấy rõ hơn tầm quan trọng thực tiễn của liên kết cộng hóa trị trong lĩnh vực môi trường, chúng ta hãy cùng lắng nghe ý kiến từ một chuyên gia.
Ông Nguyễn Văn Nam, một kỹ sư hóa học môi trường với hơn 15 năm kinh nghiệm trong ngành, chia sẻ:
“Trong công việc hàng ngày, chúng tôi liên tục đối mặt với các hóa chất, từ nước thải công nghiệp chứa các hợp chất hữu cơ phức tạp đến khí thải nhà máy với các oxit phi kim. Việc hiểu rõ bản chất liên kết cộng hóa trị của các chất này là chìa khóa để chúng tôi lựa chọn phương pháp xử lý phù hợp. Ví dụ, để xử lý các hợp chất hữu cơ bền vững như thuốc trừ sâu hoặc PCB, chúng tôi cần các công nghệ có khả năng phá vỡ các liên kết cộng hóa trị rất mạnh như C-Cl. Hoặc khi thiết kế hệ thống lọc khí, chúng tôi cần biết cách các phân tử khí (như SO2, NO2) tương tác với vật liệu hấp phụ, mà sự tương tác đó lại phụ thuộc vào độ phân cực và khả năng tạo liên kết của chúng, vốn được quyết định bởi liên kết cộng hóa trị. Nói cách khác, liên kết cộng hóa trị không chỉ là kiến thức hóa học cơ bản, mà là công cụ thiết yếu giúp chúng tôi ‘nhìn xuyên’ vào thế giới phân tử của chất ô nhiễm và tìm ra cách ‘thuần hóa’ chúng.”
Lời chia sẻ từ chuyên gia cho thấy, ngay cả trong những ứng dụng thực tế nhất, kiến thức về liên kết cộng hóa trị vẫn là nền tảng không thể thiếu.
Liên Kết Cộng Hóa Trị: Một Chuyến Du Hành Tới Thế Giới Vi Mô
Bạn thấy đấy, khái niệm liên kết cộng hóa trị là gì tưởng chừng chỉ là một bài học khô khan trong sách hóa học, nhưng thực chất nó lại là chìa khóa để mở cánh cửa hiểu biết về thế giới vật chất quanh ta, từ những thứ đơn giản nhất như không khí, nước cho đến những vấn đề phức tạp như ô nhiễm môi trường hay sự sống.
Chúng ta đã cùng nhau đi qua định nghĩa, cách hình thành, các loại liên kết (đơn, đôi, ba), sự phân cực và không phân cực, cũng như tính chất đặc trưng của các chất có liên kết này. Quan trọng hơn, chúng ta đã thấy được tầm quan trọng của nó trong đời sống hàng ngày và đặc biệt là trong lĩnh vực môi trường, một lĩnh vực ngày càng cấp thiết đối với tương lai của chúng ta.
Hiểu được liên kết cộng hóa trị giúp chúng ta không chỉ học tốt hơn môn hóa mà còn có cái nhìn sâu sắc hơn về cấu trúc, tính chất và hành vi của các chất hóa học, từ đó đưa ra những quyết định thông minh hơn trong cuộc sống và đóng góp vào nỗ lực bảo vệ môi trường nước cũng như môi trường tổng thể.
Thế giới hóa học thật kỳ diệu phải không nào? Mỗi liên kết, mỗi phân tử đều ẩn chứa những câu chuyện riêng, góp phần tạo nên bức tranh đa sắc của vũ trụ. Chúng tôi hy vọng bài viết này đã cung cấp cho bạn những thông tin hữu ích và thú vị về liên kết cộng hóa trị.
Bạn còn câu hỏi nào về liên kết cộng hóa trị không? Hay bạn muốn tìm hiểu sâu hơn về một khía cạnh nào đó liên quan đến hóa học và môi trường? Đừng ngần ngại chia sẻ suy nghĩ và câu hỏi của bạn trong phần bình luận bên dưới nhé. Cùng nhau, chúng ta có thể xây dựng một cộng đồng yêu môi trường và trang bị kiến thức vững chắc để hành động! Hãy tiếp tục theo dõi blog của CÔNG TY TNHH MÔI TRƯỜNG HSE để cập nhật thêm nhiều thông tin bổ ích khác.
